Certifikace zdravotnických prostředků dle nařízení EU 2017/745 (MDR)
OBSAH STRÁNKY
POPIS SLUŽBY
Poptávkou se rozumí jakýkoli předběžný dotaz týkající se procesu posuzování shody a činností oznámeného subjektu. Obdrženou poptávku přezkoumá odpovědný pracovník oddělení certifikace zdravotnických prostředků, aby potvrdil kvalifikaci výrobku navrženou výrobcem. Pokud výrobek splňuje definici zdravotnického prostředku podle požadavků MDR, je zákazník požádán o poskytnutí kopie vyplněného předběžného dotazníku.
Dotazník je základem pro získání podrobnějších informací o společnosti a výrobcích žadatele a je jedním z podkladů pro stanovení poplatků za certifikační proces. Pokud dotazník neobsahuje všechny požadované informace, je žadatel vyzván k jeho doplnění.
Na základě informací uvedených v dotazníku ověří NB 1023 navrhovanou kvalifikaci a klasifikaci daného výrobku. V případě odlišného stanoviska ke kvalifikaci nebo klasifikaci výrobku je žadatel odkázán, aby se obrátil na příslušný orgán se žádostí o oficiální stanovisko. Následně je stanovisko předloženo NB 1023 k přezkoumání.
Pokud NB 1023 potvrdí správnost kvalifikace a klasifikace výrobků a pokud se na výrobky vztahuje rozsah oznámení NB 1023 , připraví NB 1023 cenovou nabídku na základě informací uvedených v předběžném dotazníku, včetně plánu projektu. V případě zdravotnických prostředků třídy IIa a IIb (neimplantabilních), které jsou popsány více samostatnými technickými soubory, může plán projektu obsahovat plán výběru vzorků pro posouzení technických souborů. Plán projektu zahrnuje posouzení technické dokumentace, úvodní audity a činnosti dohledu (pravidelný audit, neohlášený audit, případně mimořádný audit) a je stanoven na maximální dobu 5 let. Žadatel obdrží cenovou nabídku, která zahrnuje plán projektu (popis plánovaných činností) do 10 kalendářních dnů od správného vyplnění předběžného dotazníku. Pokud výrobek nespadá do rozsahu oznámení NB 1023, je poptávka zamítnuta.
Poplatky za služby nabízené NB 1023 jsou uvedeny v dokumentu Ceník služeb NB 1023.
Pokud zákazník cenovou nabídku odmítne, nebo ji v termínu 14 dní nepotvrdí, je poptávka zamítnuta, v opačném případě administrátor NB 1023 ověří, zda výrobce zadal potřebné informace (podle čl. 31 odst. 1 MDR) do systému Eudamed a získal jediné registrační číslo (SRN). V případě prostředků rizikové třídy III a implantabilních prostředků třídy IIb (s výjimkou šicích materiálů, svorek a skob, zubních výplní, rovnátek, korunek, šroubů, klínů, destiček, drátů, čepů, spon a konektorů) administrátor NB 1023 ověří, zda výrobce poskytl do elektronického systému Eudamed základní UDI-DI v souladu s ustanoveními čl. 29 odst. 1 a 3 MDR.
Pokud klient splnil registrační povinnosti, obdrží od administrátora NB 1023 formulář Žádosti o posouzení shody k vyplnění (případně lze formulář stáhnout z odkazu níže). Řádně vyplněnou a podepsanou žádost je třeba odeslat do ITC buď v listinné, nebo skenované formě nejpozději do 7 dnů. Současně je výrobce vyzván k podpisu Obecné rámcové dohody GFA-MDR (formulář dohody je výrobci zaslán administrátorem NB 1023, nebo jej opět lze stáhnout z odkazu níže). Pokud již klient s NB 1023 rámcovou dohodu GFA-MDR uzavřel (pro předchozí procesy posouzení shody), není nutno tuto dohodu uzavírat znovu.
Žádost doručená do ITC je přezkoumána z hlediska formálních náležitostí (vyplnění všech údajů, datování, podpis) a v případě nedostatků je žadatel vyzván k doplnění nebo korekci.
Po provedení kontroly žádosti je projekt registrován a výrobce obdrží přístupové jméno a heslo do webové aplikace WIDAR off-line (Web Interactive Medical Device Application and Review), která slouží jako příloha žádosti obsahující data o posuzovaném prostředku a systému kvality a současně jako komunikační nástroj mezi výrobcem a NB 1023 pro účely přezkoumání dokumentace. Vygenerování přihlašovacích údajů do WIDARu off-line může být provedeno i na základě přijetí skenované žádosti. Originál žádosti musí být doručen do ITC nejpozději dnem dodání souboru technické dokumentace.
Výrobce je povinen nejpozději do 30 dnů od obdržení přihlašovacích údajů vyplnit v aplikaci WIDAR offline veškerá požadovaná data a doručit do ITC kompletní technickou dokumentaci. Po vyplnění požadovaných dat a uzavření cyklu jsou vložená data uzamknuta a výrobce má možnost do aplikace pouze nahlížet, současně dojde ke zpřístupnění aplikace pracovníkům NB 1023, kteří můžou připojit komentáře k jednotlivým položkám.
Pokud výrobce nezpřístupní aplikaci WIDAR offline ve výše uvedené lhůtě, je upozorněn na sjednání nápravy v dodatečném termínu 7 dnů. Pokud není splněn ani tento termín, dojde k zamítnutí žádosti.
Používání WIDARu je popsáno v Příručce pro klienty - WIDAR .
Technická dokumentace, kterou výrobce zasílá v návaznosti na vyplněné údaje v aplikaci WIDAR, musí být připravena v souladu s požadavky přílohy II a přílohy III MDR.
Pro každou třídu zdravotnického prostředku musí být předložena samostatná žádost o posouzení shody včetně vyplněné aplikace WIDAR.
Po předložení řádně vyplněné a podepsané žádosti o posouzení shody, včetně vyplněné aplikace WIDAR, zkontroluje NB 1023 úplnost předložených dokumentů a přezkoumá aspekty, které by mohly vést k zamítnutí žádosti.
Důvody, které by mohly vést k zamítnutí žádosti:
- výrobek nespadá do rozsahu oznámení NB 1023 ,
- dokumentace obsahuje skutečnosti, které by mohly vést ke střetu zájmů a ohrožení nestrannosti nebo nezávislosti,
- nepoužitelnost postupu posuzování shody, který výrobce zvolil pro daný prostředek,
- žádost obsahuje několik tříd a/nebo kategorií zdravotnických prostředků, pro které musí být podána samostatná žádost,
- omezená kapacita pracovníků NB 1023 k zajištění všech požadovaných činností nezajišťuje předpoklady pro certifikaci v přijatelném časovém intervalu,
- výrobce neinformoval pravdivě o tom, že podal předchozí žádost u jiného oznámeného subjektu a žádost byla stažena nebo zamítnuta,
- výrobce neodstranil nedostatky v žádosti, o kterých byl informován,
- výrobce v požadovaném termínu po předložení žádosti nezpřístupnil ITC přílohu žádosti (aplikaci WIDAR) a nereagoval ani na urgenci ze strany ITC, takže je žádost nekompletní,
- výrobce nepodepsal a/nebo odmítl podepsat aktuálně platnou verzi obecné rámcové dohody GFA-MDR.
Pokud nejsou při posuzování žádosti zjištěny žádné překážky bránící zahájení procesu posuzování shody, obdrží výrobce kopii žádosti podepsanou ze strany NB 1023 a dojde k uzavření smluvního vztahu k projektu posuzování shody podle žádosti. Na základě celkového plánu projektu je vystavena dlouhodobá smlouva zahrnující všechny činnosti prováděné v rámci počáteční certifikace a po celou dobu platnosti certifikátu (maximálně 5 let). Smlouva současně obsahuje odkaz na dílčí smlouvy, na jejichž základě bude NB 1023 provádět jednotlivé činnosti. Uzavřením dlouhodobé smlouvy a dílčí smlouvy je formálně a technicky zahájen proces posuzování shody.
Jednotlivé kroky procesu podání žádosti a jejího přezkoumání ze strany NB 1023 jsou znázorněny v přiloženém procesním schématu.
Jazyky, kterými lze komunikovat s pracovníky NB 1023, jsou čeština, slovenština a angličtina. Veškerá technická dokumentace přiložená k žádosti musí být zpracována v těchto jazycích.
SCHÉMA CERTIFIKAČNÍ PROCEDURY DLE MDR
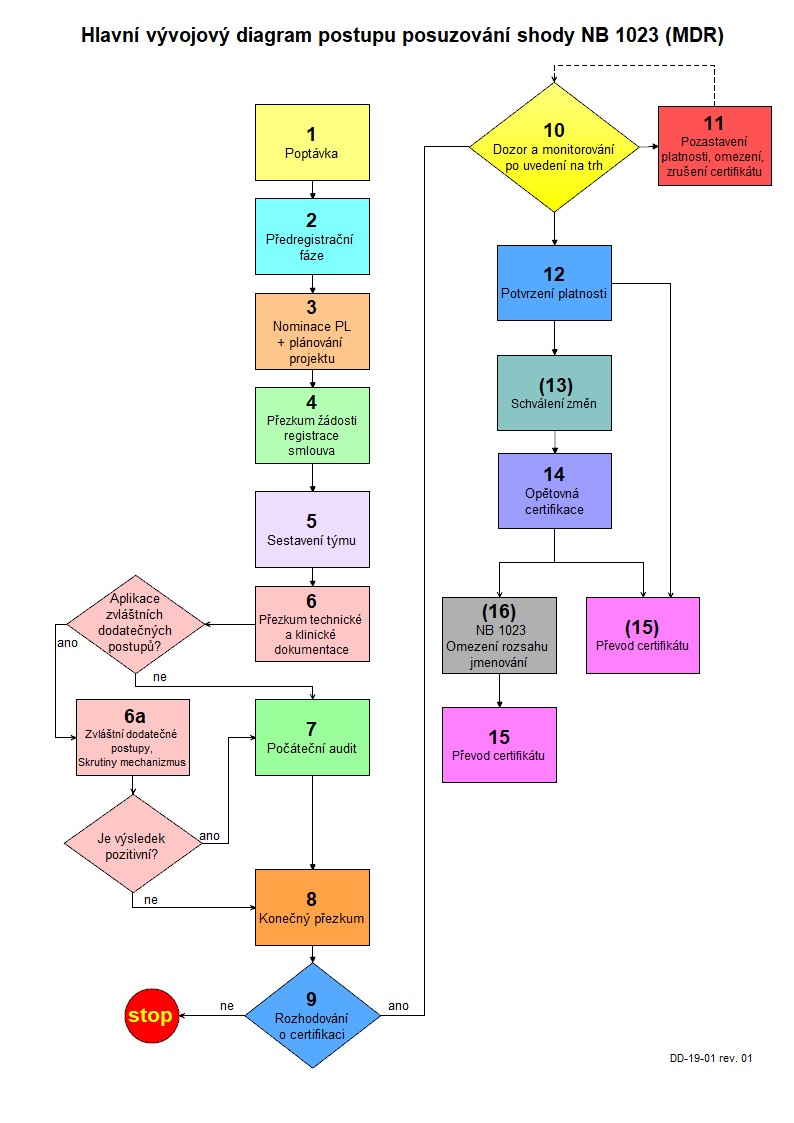
DOKUMENTY
Následující dokumenty jsou požadovány v počáteční fázi procesu posuzování shody.
WIDAR
WIDAR je offline aplikace používaná NB 1023 k prokázání splnění požadavků MDR 2017/745. Po schválení cenové nabídky a předložení žádosti o posouzení shody obdrží výrobce pokyny k používání aplikace WIDAR.
POPLATKY ZA ČINNOSTI POSUZOVÁNÍ SHODY
Poplatky za jednotlivé činnosti posuzování shody jsou uvedeny v následujícím dokumentu:
KONTAKT
Markéta Klinkovská
administrátor
Mgr. Petr Vobejda
vedoucí oddělení certifikace zdravotnických prostředků
POŠTOVNÍ ADRESA
Institut pro testování a certifikaci, a. s.
sekce certifikace zdravotnických prostředků
pracoviště Zlín, areál SVIT, budova 113
třída Tomáše Bati 5264
760 01 Zlín
Česká republika


